燃料电池
燃料电池利用氢气和氧气发电,副产物为水和热。 在其他用途中,燃料电池可用于传输和能量存储应用。
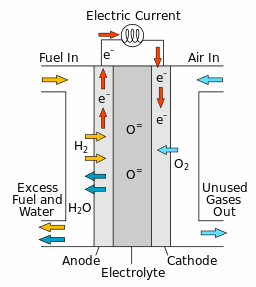
燃料电池将化学能转换为电能。 在电化学反应中,发生了两种电化学半反应 — 还原和氧化。 在还原反应中,反应物会获得电子,在氧化反应中,反应物会失去电子。 在燃料电池中,这些半反应发生在由电解质分隔的阳极和阴极交界面处。 例如,在固体氧化物燃料电池 (SOFC) 中,氧化物离子位于固体电解质膜中,阴极反应会在电解质的一侧生成这些离子。 通常,假设通过电解质膜的氧化物离子的浓度不变,但是,氧化物离子会在电场的驱动下穿过电解质膜。 而电解质另一侧的阳极反应会消耗氧化物离子。 因此,通过(在电解质的任一侧)分隔电化学半反应,燃料电池可控制组分的传输以进行发电。
这些电化学反应发生在液相和固相之间的交界面处。 有不同类型的燃料电池,可根据液相和固相之间交界面处的膜类型对其进行分类。
固体氧化物燃料电池 (SOFC)
SOFC 用于存储能量以供高温应用 (900–1000 ºC) 使用。
SOFC 主要由多孔陶瓷材料制成,它们在变为离子导电之前需要高温。 用于电解质的固体氧化物材料必须达到足够高的温度,才能支持氧化物离子的动能从阴极传输到阳极。
在此反应中产生的电子 () 将从阳极通过外部电路电导向阴极。 这样的电子流会发电。 氧气 () 通过多孔阴极扩散并与电子发生反应,以形成氧化物离子 ()。
之后,氧化物离子从阴极通过电解质传输到阳极。 该系列反应将一直继续,直到阳极处的氢燃料和阴极处的氧气耗尽。
设计燃料电池时,最显著的挑战之一是最大程度地提高其效率和性能。 这旨在最大程度地加快组分输运并减少电池中的能量损失,例如,因扩散引起的能量损失或者因陶瓷组分内的欧姆电阻引起的欧姆损失。 组分输运和能量损失受电池内多孔层的厚度、表面积或材料等变量的影响。 TPB 的特征对电池的电化学性能具有很大的影响。
在 Simcenter STAR-CCM+ 中模拟燃料电池时,可为阳极、阴极、电解质膜和极耳定义单独的固体连续体 — 其中除极耳外的所有组件都是反应域。 然后可将单独的流体连续体用于空气和燃料域 — 或者,如果空气流体和燃料流体在任何点混合,则使用一个连续体。 遵循工作流电化学表面反应建模中的准则进行操作。
使用 Simcenter STAR-CCM+ 的当前实施对 SOFC 进行建模时,需要考虑一些重要注意事项。
尤其是,设置必须遵循热力学第一定律 — 无法创建或销毁能量。 在考虑了电化学表面反应在反应域中生成和消耗的能量总和后,进入反应域的组分总能量之差必须等于离开该域的组分总能量。 可通过创建电功率通量和能量损失报告,然后使用这些报告创建监视器和单一绘图,在 Simcenter STAR-CCM+ 中检查能量守恒。
由于在反应域中反应点位紧临接近燃料和空气入口,因此有明显的流体边界扩散。 存在流体边界扩散时,指定总通量和组分浓度可能导致某些组分的通量朝向平均流的相反方向。 因此,另一个重要注意事项是确定模拟是否在整体计算中忽略流体边界扩散。